Hoy hablo del sistema buffer y su importancia en cosmética. A veces, cuando preparamos una emulsión incorporamos ingredientes que pueden hacer que el pH de la misma varíe con el paso del tiempo. Estas variaciones del pH pueden afectar diversas características de nuestra emulsión como:
- Inactivar al conservante, lo que puede llevar a la proliferación de microorganismos.
- Inactivar otros principios activos y que pierdan efectividad.
- Modificar el color y olor de la emulsión.
- Producir variaciones electrostáticas que afecten a la estructura de los espesantes o tensioactivos empleados y por tanto la emulsión acabe separándose.
Además, los cambios en el pH de la emulsión pueden reducir la función de barrera de la epidermis al alterar su manto ácido.
Para evitar esto se emplean buffers o soluciones amortiguadoras que permiten mantener el pH en valores más o menos constantes, aún cuando se añadan pequeñas cantidades de ingredientes ácidos o básicos a la emulsión.
¿Cómo funciona un buffer?
Cuando se disuelven ácidos como el láctico (C3H6O3) en agua liberan iones de Hidrógeno (H+). Por ello, acidifican el medio.
Cuando se disuelven bases como la sosa (NaOH) en agua liberan liberan iones Hidroxilo (OH–). Por ello, alcalinizan el medio.
Una solución buffer es la combinación de una especie débil y su sal conjugada. Puede ser un ácido débil y su sal conjugada o una base débil y su sal conjugada.
Un buffer es capaz de evitar los cambios de pH porque los dos componentes (la especie débil y su sal) están presentes en la emulsión en cantidades apreciables y en equilibrio y son capaces de neutralizar la adición de pequeñas cantidades de otros ingredientes ácidos o básicos.
Un ácido débil, por ejemplo el ácido cítrico (HA) en agua se disocia formando citrato (A–) y liberando hidrógeno (H3O+)

Si ahora añadimos una solución de sal (citrato de sodio NA) a la solución de ácido cítrico hasta alcanzar el pH que deseamos para nuestro buffer ocurrirá que:

La adición de citrato de sodio no afecta al pH en sí mismo porque no aporta iones hidrógenos al buffer, pero sí que incrementa la concentración de citrato A– disuelto en la solución buffer. Por consecuencia, según el principio químico de Le Chatelier, conducirá a una disociación ligeramente menor del acido cítrico (HA).
La presencia de cantidades significativas tanto del ácido conjugado AH como de la base conjugada A– le permite a la solución funcionar como buffer.
Ahora bien, ¿Cómo afecta todo esto a nuestra emulsión?
Si añadimos pequeñas cantidades de ingredientes ácidos (H3O+) a nuestra emulsión que lleva un buffer, este hará que se neutralicen. ¿Cómo? digamos y simplificando mucho que la sal conjugada A– , en nuestro caso el citrato, los neutraliza haciendo que se produzca más ácido acético. Es decir, hace que la reacción se dé más en el sentido izquierdo. Con ello disminuyen los iones hidrógenos H3O+ libres y se evita que el pH baje y que nuestra emulsión se acidifique.
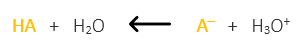
Si añadimos pequeñas cantidades de ingredientes básicos (OH–) a nuestra emulsión que lleva un buffer, este hará que se neutralicen, ¿Cómo? digamos y simplificando mucho que el ácido débil HA, en nuestro caso el ácido cítrico, los neutraliza haciendo que se produzca más citrato. Es decir, hace que la reacción se dé más en el sentido derecho. Con ellos disminuyen los iones hidroxilos OH– libres y se evita que el pH suba y que nuestra emulsión se alcalinice.
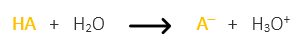
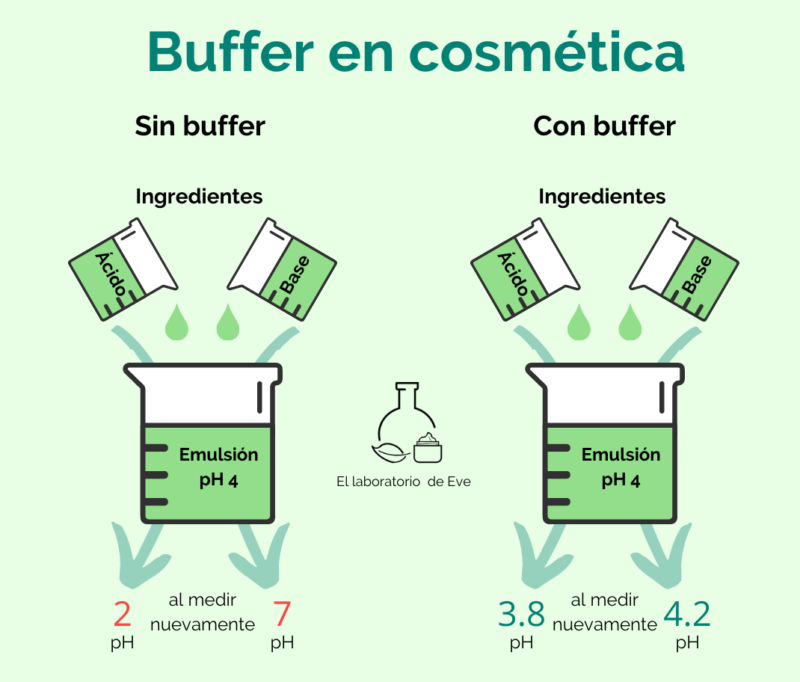
Soy consciente de que todo esto es un rollo patatero, pero tenemos que ver al buffer como un aliado que mantiene constante el pH nuestra emulsión. El buffer funciona como una balanza equilibrada. Si añadimos mucho peso de un lado, la balanza automáticamente hace lo necesario para equilibrarse nuevamente.
El buffer se puede preparar de dos formas:
- Disolviendo en agua una especie débil y su par conjugado. Es lo que haremos aquí.
- Haciendo reaccionar parcialmente (por neutralización) un ácido débil con una base fuerte, o una base débil con un ácido fuerte.
Un buffer lo podemos preparar de pH:
- Ácido: por ejemplo, para elaborar un peeling químico o una crema facial
- Neutro: por ejemplo, para elaborar un champú infantil (por aquello de que no irrite los ojos)
- Básico: por ejemplo, para elaborar tintes capilares
La elección depende de nosotros y del uso que queramos darle. En este post hablare sobre la disolución de un ácido débil y su sal conjugado en agua.
Sistemas buffer en cosmética
Conceptos
Ka: es la constante de disociación de un ácido
pKa: se trata de una medida de acidez, calculada mediante el logaritmo negativo (-log) de la constante de disociación ácida Ka. Nota mnemotécnica: todo lo que lleve una “p” es porque es un valor logarítmico. Este valor de pKa nos dice la tendencia que tiene una molécula a disociarse en agua. Un valor de pKa alto es frecuente en ácidos débiles que se disocian poco. Cuando el pH = pKa significa que un ácido está 50% en su forma ácida (activa o efectiva) y 50% en su forma no disociada.
Un ejemplo de por qué el pKa es importante en cosmética es en la elaboración de un peeling químico. El ácido glicólico tiene un pKa de 3.83 si preparas un peeling químico y ajustas el pH a 3.83 significa que el 50 % (aprox) del ácido glicólico estará en su forma ácida o “activa” por así llamarlo y por tanto será más efectivo.
Si el mismo peeling lo preparas a un pH 5 el ácido glicólico estará en mayor porcentaje en su forma “no activa” y por tanto, será menos efectivo. Si lo preparas a pH 2 el ácido glicólico estará en un porcentaje muy elevado en su forma “activa” pero literalmente te quemará la cara.
pH: es la concentración de iones hidrógeno.
Volviendo a las soluciones buffer (que me voy por las ramas :P) en cosmética se emplean varios pero como ejemplos tenemos estos dos:
- Ácido cítrico / Citrato de sodio (A): El ácido cítrico tiene 3 valores de pKa = 3.13 – 4.77 – 6.40
- Ácido láctico / Lactato de sodio (B): El ácido láctico tiene un único valor de pKa = 3.86
La elección de uno u otro (A o B) dependerá del pKa del ácido y del pH que queremos para nuestro producto cosmético.
Explicación
Si quiero preparar un producto cosmético con un pH 7 debo emplear el buffer Ácido cítrico / Citrato de sodio dado que el ácido cítrico tiene un pKa de 6.40 lo cual está bastante cercano al pH deseado.
NOTA: el mejor buffer es aquel que tiene un pka lo más cercano al valor de pH que buscamos, porque eso significa que hay la misma cantidad del ácido débil y de su sal conjugada. Es decir, están en equilibrio.
Pero ¿qué pasa si quiero preparar un producto cosmético de pH 4? Podría emplear el buffer Ácido cítrico / Citrato de sodio dado que el ácido cítrico también tiene un pKa de 4.77 valor bastante cercano a 4. Sin embargo, como tiene otros pKa 3.13 y 6.40 podrían ocurrir variaciones y que mi buffer fluctuara. Por lo cual, lo más indicado sería utilizar el buffer Ácido láctico / Lactato de sodio ya que ácido láctico solo tiene un valor fijo y único de pKa (3.86) y no habrá fluctuaciones.
Resumen
Ácido cítrico / Citrato de sodio puede funcionar en rangos de pH de 2 – 7, pero es mejor emplearlo en rangos de 5 – 7.
Ácido láctico / Lactato de sodio funciona con un rango de pH de 3 – 5.
Si te interesa realizar tus propios cálculos, o al menos conocer cómo se realizan, te recomiendo estos videos. Aunque también dispones de aplicaciones móviles como Lab Hacks o webs como ATT Bioquest (buffer citrato) que te realizan los cálculos. Incluso hay tablas con los cálculos hechos para determinado pH y concentración.
Si aún así te interesa saber cómo hacer los cálculos, sigue leyendo.
¿Cómo realizar los cálculos para preparar un buffer?
Para estos cálculos vamos a preparar una solución buffer que emplea un ácido y su sal conjugada, es decir, ácido láctico y lactato de sodio.
Como ya he mencionado anteriormente, el sistema buffer más adecuado (más efectivo) es el que tiene el valor de pKa lo más cercano posible al pH que se deseamos regular. Yo voy a emplear un buffer de ácido láctico porque quiero que mi emulsión tenga un pH 4 y el ácido láctico tiene un valor de pKa de 3.86 que se aproxima bastante a lo que necesito.
Mi buffer tiene un pH 4 y lo usaré para preparar una crema de pies de ácido salicílico y urea.
Para realizar los cálculos empleamos la ecuación de Henderson-Hasselbalch que nos permite calcular el pH de un buffer a partir del pKa y de la concentración de equilibrio de nuestro ácido (en este caso láctico) y su sal (lactato).
pH = pKa + log( [lactato] / [ácido láctico] )
pH es la concentración de iones hidrógeno. En mi caso, yo deseo que el pH de mi emulsión sea de 4. Por tanto, conozco este valor.
pKa es la constante de disociación del ácido. En este caso, la del ácido láctico es 3.86.
Mi incógnita es la concentración de equilibrio del ácido y su sal. Es decir, la concentración de uno y de otro en la que la reacción se puede dar por igual en ambas direcciones. Así que debo despejar la ecuación:
pH – pKa = log( [sod. lactate] / [lactic acid] )
4 - 3.86 = log( [sod. lactate] / [lactic acid] )
0.14 = log( [sod. lactate] / [lactic acid] )
Resolviendo el logaritmo tenemos:
1.38/1 = [sod. lactate] / [lactic acid]
Esto significa que, por cada mol de ácido láctico debe haber 1.38 moles de lactato de sodio para que la reacción esté en equilibrio.
El buffer lo voy a preparar en una concentración molar de 0.1 M. Eso queda a tu elección. También te digo que a mayor concentración, mayor capacidad de amortiguar frente a los cambios de pH
Sabiendo ya la molaridad que quiero para mi solución buffer decimos que:
[lactato] + [ácido láctico] = 0.1 M
*por si no lo sabes en química el uso de corchetes [ ] significa concentración. Por tanto, [lactato] significa la concentración de lactato y [ácido láctico] significa la concentración de ácido láctico.
Ahora bien, desconozco las concentraciones de lactato y ácido láctico pero conozco la relación que hay.
[lactato] /[ácido láctico]= 1.38/1
Por tanto puedo despejar
[lactato]= 1.38*[ácido láctico]
y sustituyo esto en la ecuación: [lactato] + [ácido láctico] = 0.1 M
(1.38*[ácido láctico])+ [ácido láctico] = 0.1 M
Resolviendo esto tenemos
1.38 [ácido láctico]+ 1 [ácido láctico] = 0.1 M
2.38 [ácido láctico] = 0.1 M
[ácido láctico] = 0.1/2.38
[ácido láctico] = 0.042 moles/litro = 0.042 M
Ahora bien, sabemos que
[lactato] + [ácido láctico] = 0.1 M
y ahora conocemos el valor de [ácido láctico] = 0.042
Así que despejando
[lactato]= 0.1 M - [ácido láctico]
[lactato]= 0.1 M - 0.042 M
[lactato]= 0.058 M
Ahora solo me queda pesar el lactato y el ácido láctico. Para ello debo llevar esto a gramos. Para hacerlo me valgo de la siguiente ecuación.
masa = Peso molecular * número de moles
Lo ideal sería obtener los pesos moleculares de nuestro proveedor para conocer la pureza de nuestros reactivos. Yo no dispongo de esos datos así que utilizaré los pesos moleculares de wikipedia.
Peso molecular del lactato de sodio es: 112.06 g/mol
masa = 112.06 g/mol * 0.058 mol
masa = 6.5 g
6.5g de lactato para 1 litro de buffer pero yo voy a preparar 100 ml así que necesitaré 0.65 g de lactato.
Peso molecular del ácido láctico: 90.08 g/mol
masa = 90.08 g/mol * 0.042 mol
masa = 3.78 g
3.78 g de ácido láctico para 1 litro de buffer, pero yo voy a preparar 100 ml así que necesitaré 0.378 g de ácido láctico.
Ya sabemos que debo preparar mi solución de 100 ml de buffer 0.1 M con 0.378 gramos de ácido láctico y 0.65 gr de lactato de sodio.
En el siguiente post veremos cómo se elabora e incorpora en la emulsión.
Y tú ¿has empleado alguna vez un buffer en tus cremas?
Declaración: El laboratorio de Eve participa en varios programas de afiliación (más información en términos y condiciones), eso significa que recibo una pequeña compensación económica por las compras que se realizan a través de los links que te pongo y que direccionan a sitios web de compra online, sin que ello repercuta en un sobrecoste para ti. Hacer clic en los enlaces y comprar depende de ti. Nunca te mentiré para que compres algo que yo misma no compraría. A mí esa compensación me sirve para comprar ingredientes y materiales y así poder seguir generando contenido en el blog.




19 ideas sobre “Buffer en cosmética casera”
Gracias eve,acabo de descubrir tu blog y ya con esta enseñanza vale oro.saludos desde chile.
Muchísimas gracias, me alegro de que los post os sean de utilidad. Vuestros comentarios me animan a seguir generando contenido. Saludos desde España
Hola,
Te acabo de descubrir y tu blog me parece muy interesante.
Me gusta mucho este artículo, está muy bien explicado. Espero a la segunda parte.
Muchas gracias por compartir tus conocimientos.
Hola Isa, me alegro de que te guste el post. Estoy trabajando en la segunda parte. Me gusta realizar algunas pruebas de estabilidad antes de subir fórmulas, estoy testando la repetición de la receta. Si todo va bien pronto subo el post. Un saludo.
Hola Eve
Gracias por tu blog y por el conocimiento que ofreces, es un tesoro.
Con respecto a esta entrada sobre el buffer me gustaría preguntarte una duda que me surge ¿qué cantidad de buffer se añade a una emulsión?
Gracias de antemano y un gran saludo.
Hola, la cantidad varía en función de tú formula. No te puedo decir valores en porcentaje porque depende de los ingredientes de los que se compone tu fórmula. Lo suyo es incorporar la solución tampón (preparada previamente) poco a poco a la fórmula e ir midiendo hasta alcanzar el pH deseado. Siento responder tarde y espero que te sea útil la respuesta.
Me parecen excelentes todos tus blogs, muchas gracias por compartir tu conocimiento. Quedo atenta a la segunda parte de este blog.
Muchas gracias María, me alegro de que os gusten y sobre todo de que os sirvan para vuestras elaboraciones. Saludos
Muchas gracias por la aclaración!
me ha servido muchisimo ya que iba a usar acidos sin conocimientos
espero ansiosamente la segunda parte, para saber como agregarlo
Hola! Gracias a tu blog, estoy empezando a entender este tema del buffer pero.. perdón por mi ignorancia.. cuando hablan de.moles, a qué se refieren? 😅
Hola, mol es una unidad de medida del sistema internacional. Es muy empleada en química para realizar cálculos. Aunque al momento de elaborar cualquier experimento luego lo llevemos a otras unidades como gramos o litros.
Hola Eve:
Si tengo lactato de sodio al 60% y ácido láctico al 88%, (xq asi lo puedo conseguir) ¿Cambian los gramos necesarios para el buffer de 100ml?
Hola creo que este video te lo explica perfectamente https://www.youtube.com/watch?v=BAcNrxTT7P8 espero que te sirva de ayuda.
Interesante y completo, si estoy trabajando con ácido láctico al 80% el calculo seria los gramos de ácido láctico obtenidos 0.378 entre el 80% por 100 me daría los gramos que debo colocar en la emulsión, me gustaría saber si es así.
Saludos y gracias.
¡Hola, hola! Miles de gracias por regalarnos tu sabiduría. Estoy buscando el post donde cuentas cómo usar el búffer en una fórmula pero no lo encuentro, ¿sería posible que me pasaras el enlace? ¡Miles de gracias!
Por cierto, voy compartiendo tus artículos en el grupo de Fitocosmética que administro de facebook, este es el enlace por si quieres formar parte de él., https://www.facebook.com/groups/224630951213584 y si eres tan amable de pasarme tu artículo por mail a info@corazonverde.org sería todo un regalo. ¡Gracias!
Hola, me alegra que la información os sea de utilidad. En cuanto al post lo tengo escrito pero sin terminar, lo sé, soy un desastre. Intentaré sacar tiempo para subirlo esta semana. Gracias por la invitación al grupo. Ya me he unido.
Buenas tardes. Es interesantísimo el artículo.
El ácido lactico que comercializan en las tiendas de cosmética casera está al 80%, por lo que imagino que hay que hacer correcciones para preparar el buffer. y por otro lado ¿Cómo podemos preparar en casa el lactato de sodio?
He buscado la entrada de “cómo se elabora e incorpora en la emulsión”, pero no la he encontrado. Gracias
Hola Elena, sí debes hacer los cálculos necesarios para a partir de ese ácido láctico al 80% utilizar los mg que necesites. Es básicamente una regla de 3. En cuanto a preparar el lactato de sodio se hace a partir de ácido láctico e hidróxido de sodio, personalmente no lo he realizado nunca porque prefiero comprarlo y ahorrar en tiempo. Si tienes experiencia usando hidróxido de sodio y quieres prepararlo te dejo este link https://gothicshollowlab.home.blog/preparation-of-sodium-lactate-lactic-acid-neutralisation/ para hacerlo. Recuerda tomar todas las medidas de seguridad necesarias para protegerte (guantes, gafas de seguridad, mascarilla y bata)
Hola que tal, estoy siguiendo la fórmula de buffer Lactato/Láctico pero me pierdo en el 1.38/1=log… De dónde sale el 1.38 de multiplicar, sumar o restar que cantidad por cuál, muchísimas gracias espero pued ayudarme 🙌🌼